1.题目:物质的量
2.内容:

3.基本要求:
(1)试讲时间约10分钟;
(2)试讲过程注意对学生的引导;
(3)配合教学内容适当的板书。
【试题解析】
一、导入新课
【教师提问】让学生称量1粒小米、1粒大米的质量,然后再称量100粒小米、100粒大米的质量。结论为用托盘天平难以称量它们1粒的质量,而称100粒的质量是极易办到的。而小米、大米都是宏观物体而不是微观粒子,可见肉眼看不到的单个的粒子——原子、分子、离子等更难以称量。那么,科学上是用什么物理量将一定数目的原子、分子、离子等粒子与可称量的物质联系起来的呢?这就是我们本节课学习的“物质的量”。
二、新授
1.物质的量
【教师展示】水与水的微观构成示意图。
【教师提问】怎样才能既科学又方便地知道一定量的水中含有多少个水分子呢?
【教师过渡】建立一个桥梁,把多个微粒当作一个整体来计量,这就是我们要学习的新的物理量—物质的量。
【教师讲解】生活中相对较小的物体常用许多个体的集合作为一个整体来表示,比如去超市买米,常用“斤”或“千克”来表示米的多少。对于肉眼看不见的微观粒子,用“个”描述物质的粒子的数目非常的不方便。因此用“摩尔”作为物质的量的单位。摩尔来源于拉丁文moles,原意是大量和堆积。“摩尔”mol描述许多微粒集合的单位,它可以计量所有微观粒子。
2.阿伏加德罗常数
【教师提问】集合多少数量的微粒子才能达到可以看得到的目的?
【教师引导】同一个化学反应方程式表示的意义是相同的,所以微观粒子和宏观粒子之间存在联系。一个碳原子的质量为 克,一个氧分子的质量是 克。引导学生计算12克碳中含有的微粒?
【学生活动】通过计算后微粒数为 。
【教师活动】提问学生是否其他物质所含有的微粒数也是相同的,学生计算其他物质的微粒数,结果相同。
【教师活动】提问学生,多少的微观粒子作为集合标准?
【学生活动】选择 ,这个标准可以将物质的量和微观粒子数联系在一起。
【教师活动】国际上,摩尔这个单位是以0.012kg12C中所含的碳原子数目为标准,即1mol粒子集合所含有的粒子数与0.012kg12C中所含的原子数相同,约为 。规定,把1mol.任何粒子数叫阿伏伽德罗常数,符号为NA, mol-1表示
3、物质的量、阿伏伽德罗常数、粒子数
【教师 活动】提问,2摩尔水含有多少个水分子?2摩尔水中所含有的分子数与2摩尔氧气含有分子数是否相同,1摩尔水的质量,与1摩尔铝的质量是否相同?
【学生活动】1摩尔不同物质中所含的粒子数是相同的;1摩尔不同物质的质量也不同。
【教师活动】请同学总结物质的量、阿伏伽德罗常数、粒子数之间的关系?
【学生活动】 三、巩固练习:
【教师活动】提问1mol氢气含有的氢原子数
【学生活动】对于答案,存在不同、
【教师总结】题目中的表示容易产生分歧,需要注意在使用摩尔表示物质的量时,应该用化学式指明粒子的种类。应该如何问,如何回答呢?
四、课堂小结
教师提问学生本节课的收获,学生总结。
五、布置作业
完成课后练习题
六.板书设计
物质的量
一、物质的量
二、阿伏伽德罗常数
三、物质的量、阿伏伽德罗常数、粒子数
1.题目:甲烷
2.内容:


3.基本要求:
(1)试讲时间约10分钟;
(2)试讲过程注意对学生的引导;
(3)配合教学内容适当的板书。
【试题解析】
一、导入新课
2005年某小区发生瓦斯爆炸事件,以及我国的西气东输,由此引入新课。
二、新授
【教师活动】甲烷之所以是最简单的有机物是由于只含有一个碳原子,而且只含有两种元素:碳元素和氢元素,同学们能否根据学过的知识尝试写出甲烷的分子式?
【学生活动】碳为-4价,氢为+1价,可以写成CH4
【教师活动】根据甲烷的分子式可以写出甲烷的电子式和结构式。
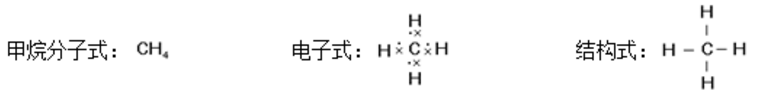
【教师活动】教师讲解,甲烷分子式一个以碳为中心的正四面体结构,碳与每个氢之间形成的键长键脚都是相同的。下面大家用自己手中的橡皮泥和牙签做一个甲烷的模型,观察一下它的结构?
【教师活动】一般我们研究物质的性质都是从哪些方面 进行研究的?
【学生活动】物质的颜色、状态、等
【教师活动】根据分子式和结构式,判断甲烷的密度?
【学生活动】甲烷的密度比空气小。甲烷的相对分子质量是16。
【教师活动】播放一段甲烷的视频,了解甲烷的其他性质。
【学生活动】没有观察到任何现象。
【教师活动】说明在反应中生成物看不见,从甲烷的分子式试推断一下生成物。
【学生活动】生成物可能是二氧化碳和水。
【教师活动】多媒体展示,甲烷燃烧生成产物的过程,通过烧杯的水珠以及变浑浊的石灰水,进一步验证了我们的猜想
【学生活动】写出反应方程式 【教师活动】甲烷燃烧是一个氧化的过程,那么甲烷在其他条件下是否容易氧化?
【教师活动】将甲烷气体通入高锰酸钾溶液中,观察熔岩颜色变化。
【学生活动】无变化
【教师活动】甲烷性质稳定不与酸性高锰酸钾反应,也不和酸和碱反应。
【教师活动】将饱和食盐水、20ml甲烷和80mlCl2一起放在光亮的地方,观察实验现象。
【学生活动】气体的颜色变浅液面上升,出现油滴。说明在光照条件下,甲烷与氯气生成新物质。
【教师总结】甲烷与氯气在光照下的反应式分步进行的,请同学们观察多媒体中甲烷与氯气的反应原理
【教师活动】一氯甲烷为气体,二三四氯甲烷是液体,这种反应叫做取代反应,请同学们根据反应总结取代反应的概念。
【学生活动】取代反应指有机物分子中的一个院子或原子团被试剂中同类型的其他院子或集团取代的反应。
三、巩固练习:
下列气体在氧气中燃烧后,其产物既可以使水硫酸铜变蓝又可以使澄清的石灰水变浑浊的是
A.H2S B.CH4 C.H2 D.CO
四、课堂小结
教师提问学生本节课的收获,学生总结。
五、布置作业
完成课后练习题
板书设计
甲烷
一、甲烷分子式、电子式、结构式
二、物理性质
三、化学性质
1.题目:石蜡油的分解
2.内容:

3.基本要求:
(1)试讲时间约10分钟;
(2)试讲过程注意对学生的引导;
(3)配合教学内容适当的板书。
【试题解析】
一、导入新课
在生活中我们经常会把没有成熟的水果和香蕉放在一起,这样没有成熟的水果很快就能食用这是什么原因?
其实是因为成熟的水果会散发出一种物质——乙烯,具有催熟作用。除此之外,乙烯还具有哪些性质呢?带着这些问题学习今天的内容。
二、新授
1.石蜡油分解实验
【教师讲授】煤是工业的粮食,石油是工业的血液,从煤和石油中可以得到多种化工产品。乙烯是一种重要的石油化工产品,也是重要的石油化工原料。乙烯的产量也是衡量一个国家石油化工产业发展水平的标志。
【提出问题】乙烯到底具有怎样的物质,如何从石油中得到乙烯呢?从石油分馏中得到的石蜡油进一步加热会得到什么?
【播放视频】石蜡油分解实验。
【提出问题】请观察将产生的气体通入溴的四氯化碳溶液、高锰酸钾溶液的实验现象。
【学生回答】两种溶液均褪色。
【提出问题】烷烃能够发生类似的反应吗,这样的实验现象说明石蜡油分解产生的气体中含有的物质与烷烃有什么不同?
【学生回答】对比之前有关甲烷性质的学习,烷烃并不能产生类似的现象,说明石蜡油分解的产物中有不同于烷烃的物质,可以与溴的四氯化碳溶液、酸性高锰酸钾溶液反应使其褪色。
【教师讲述】研究表明,石蜡油分解的产物中含有烯烃和烷烃。烯烃分子中含有碳碳双键
2.乙烯的结构
【多媒体展示】乙烯的球棍模型和比例模型。
【提出问题】结合甲烷的电子式、结构式、结构简式的写法尝试写出乙烯的电子式、结构式、结构简式。
乙烯的分子结构:两个碳原子和四个氢原子在同一平面上,键角为120°,结构简式为H2C=CH2。
【教师讲授】对比烷烃的结构,双键中有一根键比较“脆弱”易断裂,这也就决定了乙烯的性质比甲烷的性质更加活泼——即结构决定性质。
3.乙烯的化学性质
(1)乙烯的氧化反应
【播放视频】乙烯在空气中燃烧。
【提出问题】观察实验现象,与甲烷燃烧的现象有何不同,尝试写出乙烯燃烧的化学方程式。
【学生回答,老师总结】乙烯在空气中燃烧,火焰明亮且伴有黑烟,生成二氧化碳和水,同时放出大量热。
【教师讲授】乙烯不仅可以被氧气氧化,还可以被酸性高锰酸钾这一类强氧化剂所氧化,因此我们在之前石蜡油分解实验中可以观察到乙烯使酸性高锰酸钾褪色。
【提出问题】根据这一性质思考如何鉴别乙烯与甲烷?
【学生回答】可以把气体分别通入酸性高锰酸钾溶液中,能够使其褪色的是乙烯,不能使其褪色的是甲烷。
【教师讲授】这一性质与乙烯分子中含有碳碳双键是有关的。
(2)乙烯的加成反应
【提出问题】乙烯与溴反应使溴的四氯化碳溶液褪色,这一性质与乙烯的分子结构又有怎样的关联呢?
【多媒体播放+板书展示】乙烯与溴发生反应的示意图。
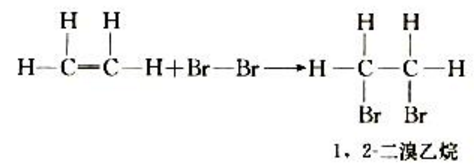
【教师讲授】反应中,乙烯双键中的一个键断裂,两个溴原子分别加在两个价键不饱和的碳原子上,生成无色的1,2-二溴乙烷液体。 有机物分子在中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫加成反应。
【提出问题】乙烯不仅可以与溴发生加成反应,在一定条件下,还可以与H2、HCl、Cl2、H2O等物质发生加成反应,你能尝试写出其反应方程式吗?
【学生回答,教师总结】
【提出问题】如果是多个乙烯分子发生加成反应呢?
【教师讲述】
![]()
三、巩固练习:
对比取代反应与加成反应之间有何区别? 请学生进行小组内的归纳总结。
四、课堂小结
教师提问学生本节课的收获,学生总结。
五、布置作业
作业:课后了解实验室中制备乙烯得方法。
六.板书设计
石蜡油的分解
一、乙烯的分子结构
二、乙烯的化学性质
1.氧化性
2.加成
3.聚合
1.题目:硫和含硫化合物
2.内容:

3.基本要求:
(1)试讲时间约10分钟;
(2)试讲过程注意对学生的引导;
(3)配合教学内容适当的板书。
【试题解析】
一、导入新课
【教师活动】教师播放有关酸雨的视频酸雨视频展示酸雨对我们环境,建筑物及人类生活生产的影响。引导学生思考问题酸雨危害有哪些,酸雨的主要成分有什么?
【学生活动】酸雨主要成分有二氧化硫、二氧化氮、一氧化氮等。
【教师活动】大家请再看看大屏幕上展示的图片,酸雨对空气污染的报告,SO2中毒现象,被SO2 漂白过的食物,这些现象中都有一种化学物质,是什么? 学生回答:SO2,由此引出本节课学习的内容
二、新授
1.SO2 的物理性质研究
【教师活动】多媒体呈现并讲授:二氧化硫中重要的硫元素:淡黄色晶体,脆,不溶于水,微溶于酒精,易溶于CS2。硫或者含硫化合物在空气中燃烧首先生成二氧化硫。化学方程式为: ,硫在空气中燃烧发出淡蓝色的火焰,在纯氧中燃烧发出明亮的蓝紫色火焰。
【教师活动】提问经过前面的学习,大家思考下我们从哪些方面可以确定SO2 的物理性质呢?
【教师引导】回忆上节课研究氯气的性质的方法,思考从哪些方面去研究SO2 的性质。
【师生活动】:说出从颜色、状态气味、密度、毒性、溶解性方面去研究物质的物理性质。
【教师活动】你对哪条性质还不了解?你能利用一个装满SO2的试管来设计实验说明吗?
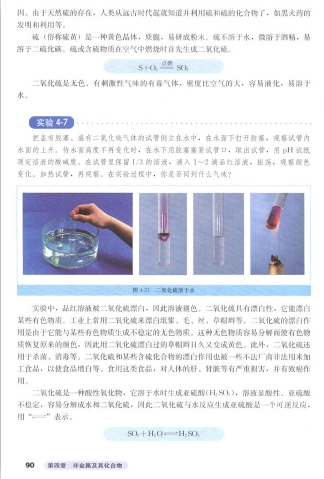
【教师演示实验】实验SO2的溶解性。经过实验大家观察到,SO2 是溶于水的。
【学生活动】学生归纳SO2物理性质:SO2是无色有刺激性气味气体,密度比空气大,容易液化,易溶于水。
2.SO2 的化学性质研究
3.二氧化硫与水的反应
【教师活动】在上述实验中,SO2溶于水后滴入石蕊试剂溶液变红,对照我们之前学过的知识,我们可以得出什么结论?
【学生活动】SO2溶液呈酸性 【教师活动】请大家写出SO2溶于水的化学方程式?
学生书写教师强调:注意 是可逆反应,
探究一:从分类的角度SO2属于哪类物质?具有该类物质的哪些通性?
【教师活动】下面我们从分类的角度想,既然SO2溶液显酸性,那么SO2属于哪类物质?想想具有该类物质的哪些通性?
【学生活动】是酸性氧化物,(总结归纳出SO2作为酸性氧化物的通性):酸性氧化物可以和碱反应,和碱性氧化物反应,和水反应等等。
【教师活动】请两位同学来黑板上给大家展示一下SO2与CaO、Ca(OH)2反应的化学方程式。
学生板演师生共同判断正误。
探究二:二氧化硫的漂白性
【教师活动:】农民伯伯夏天劳作的时候也是带“太阳帽”的,他们这个太阳帽是用草编的,相信很多同学都没有见过,没关系,请看大屏幕,(展示新草帽、旧草帽图片),同学们看看两个草帽颜色有区别吗?说明SO2有什么化学性质?
【学生活动】颜色不同,说明SO2有漂白性。
【教师活动】请同学们阅读教材上第90页关于SO2漂白性的原理和其不稳定性,想想具有漂白性的物质还有哪些?其漂白原理与SO2的漂白是不是相同?
【学生活动】学生阅读思考:上节课学过的氯气也有漂白性。氯气的漂白是因为它的氧化性。
【教师活动】教师提出问题:从氧化还原的角度思考SO2具有哪些性质?
【学生活动】学生实验探究:上讲台将SO2通入到老师准备好的酸性高锰酸钾溶液,观察现象,并对反应后溶液进行加热。
【教师引导】大家观察分析下,SO2中S元素的化合价是几价?说明什么呢?
学生回答:正四价,处在硫的中间价态,所以可以得出SO2既具有氧化性,又具有还原性。
学生讨论探究:由学生代表上讲台用教师提供的试剂(石蕊试液、SO2水溶液、品红溶液、双氧水、溴水、酸性高锰酸钾溶液)仪器或用品,选择合适的用实验的方法来证明SO2具有还原性。
教师评价指导。
【教师活动】讲授:SO2的氧化性,我们可以通过一个化学反应方程式来理解。
三、巩固练习:
教师设问:我们刚才学习了二氧化硫具有漂白性,大家也说出了两者的漂白原理是不同的,那大家会不会应用呢,我们通过一道习题来巩固下:
二氧化硫和氯气都具有漂白性,若将等体积的二氧化硫和氯气充分混合后,通入湿润的有色物质,可观察到有色物质发生什么现象?
四、课堂小结
教师提问学生本节课的收获,学生总结。
五、布置作业
收集当地的雨水样品,测定其pH。如果是酸雨,分头了解产生的原因,提出防治对策的建议。
六.板书设计
硫和含硫化合物
一、二氧化硫的物理性质
二、二氧化硫的化学性质
1.SO2和H2O反应
2.SO2的漂白性
3.SO2的氧化性和还原性
1.题目:铁能不能与水蒸气反应
2.内容:
科学探究:铁不能与冷、热水反应,但能否与水蒸气反应?
请设计一套简单的实验装置,使还原铁粉与水蒸气反应。这套装置应包括水蒸气发生、水蒸气与铁粉反应、检验产生的气体等部分。(也可用干净的细铁丝代替还原铁粉进行实验)

①如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其他必要的仪器和物品,画出你设计的装置简图。
②有人设计了如图3—8所示的装置,用一支稍大一些的试管代替3支试管就能完成实验,想想其中的原理。你愿不愿意试一试?
③任选一种方案进行实验。
④在下表中记录实验现象。
⑤小结并交流探究活动的收获

3.基本要求:
(1)试讲时间约10分钟;
(2)试讲过程注意对学生的引导;
(3)配合教学内容适当的板书。
【试题解析】
一、导入新课
以问题导入的方式导入新课,在上课之初提问学生上节课学习的金属钠与水反应的现象,学生给出反馈,金属钠与水反应的现象是游、溶、浮、相、红,由此引导学生学习今天的新课,铁能不能与水蒸气反应。
二、新授
【学生活动】将一根光亮的细铁丝放入盛有冷水的烧杯中,观察有什么现象?
【学生活动】将1根光亮的细铁丝放入盛有热水的烧杯中,观察有什么现象?
【学生活动】将1根光亮的细铁丝在酒精灯中加热至红,然后迅速放入盛有水的烧杯中,观察有什么现象?
【教师提问】通过观察三个实验,发现都有哪些现象。
【学生回答】实验1无现象;实验2无现象;实验3细铁丝表面变黑。
【教师提问】通过实验3,推测铁与水蒸气在加热条件下可以发生反应吗?若能发生反应,其产物是什么?
【学生活动】可以发生反应;产物可能是氢氧化铁或三氧化二铁或四氧化三铁和氢气
【教师提问】如何设计实验来实现这个反应,并对产物进行验证?
【教师引导】设计实验可以包括:水蒸气的发生部分、水蒸气与铁的反应部分、产物的验证部分。 并强调设计实验装置的主要依据:(1)反应的状态;(2)反应条件;(3)产物的性质。
【教师提问】如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精喷灯及其他必要的仪器和物品,应该如何设计实验?画出你设计的装置简图。
【教师总结】我们还可以用一支稍大一些的试管代替3支试管来完成实验。

【学生活动】按照试验步骤进行试验、观察试验现象并作出总结,在试验过程中教师全程巡视指导。
【教师活动】试验中有哪些现象?从这些现象中又可以得出哪些结论?
【学生活动】实验现象:1.试管壁上出现黑色固体,同时放出大量的热,并产生一种无色无味,点燃可发出淡蓝色火焰,并产生爆鸣生的气体。
2.气体产物是氢气;固体产物不是氢氧化铁,也不是三氧化二铁,因为产物是黑色,因此可能是四氧化三铁。
【教师活动】根据实验我们可以得出铁与水蒸气的化学反应方程式: 三、巩固练习:
【教师活动】课本上给出的实验,设计思路和优点在哪里?
【学生活动】少量水蒸气可以用湿棉花制备,少量氢气可以用肥皂泡收集,再进行点燃检
四、课堂小结
教师提问学生本节课的收获,学生总结。
五、布置作业
课后总结总结实验探究的注意事项和心得体会。
六.板书设计
铁与水蒸气反应
一、实验装置
二、实验原理
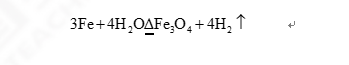
题目1:甲烷的取代反应
题目2:工业制硝酸

最后,华图教师希望各位考生能够努力学习、积极备考、持之以恒、克服困难,早日圆教师梦想!
文章来源于中国教师资格网
本文链接:https://ah.huatu.com/2024/0905/2927115.html
——相关阅读——
辅导课程--2024教师资格考试网络课程|图书资料|面授课程
招考信息--2024年教师资格证考试公告|普通话测试报名公告
考试相关--2024年教师资格考试报名入口|教师资格认定公告
备考资料--历年教师资格笔试试题及解析|面试试题及解析
更多资讯请继续查看:安徽教师招考网(https://ah.huatu.com/jiaoshi/)、安徽教师资格证考试网(https://ah.huatu.com/jiaoshi/zige/)。
以上是2019下半年教师资格面试考试高中化学试题及解析4的全部内容,更多资讯请继续查看:安徽教师资格考试网(https://ah.huatu.com/jiaoshi/zige/)、安徽省中小学教师招聘考试网(https://ah.huatu.com/jiaoshi/)。
(编辑:安徽华图)









